bet36体育投注_bet36体育官网app-在线*开户工学部生物工学科の蟹江治教授と帝京大学リベラルアーツセンターの片山秀和教授らの研究グループは、アミノ酸28個からなる環状ペプチド*1の合成に成功し、一定のマクロファージ*2活性化能を有することを確認しました。
本研究の成果は、2025年3月14日(金)〔米国東部時間〕にアメリカ化学会誌『Journal of the American Chemical Society』のオンライン速報版で公開されます。
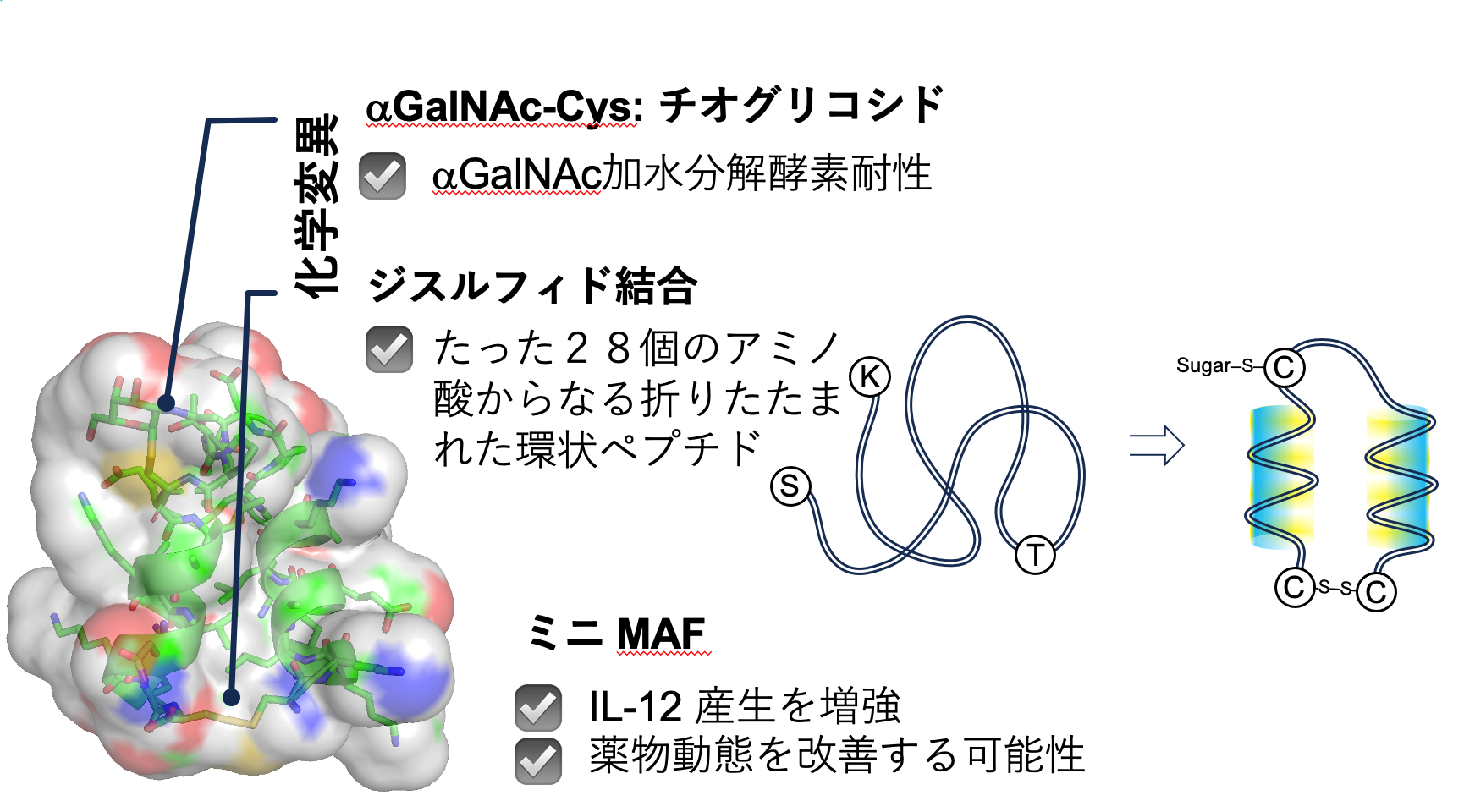
合成に成功した環状ペプチドの設計のもとになったタンパク質は、マクロファージ活性化因子(MAF)*3として知られ、分子量は約5万です。さらに、その糖鎖は体内で2種類の酵素に切断され、α-N-アセチルガラクトサミン(αGalNAc)*4のみが結合した物質となり、初めてマクロファージを活性化します。しかし、特にがん患者の血中はαガラクトサミン加水分解酵素活性*5が高いとされ、マクロファージ活性化能はなくなるとされています。そのため、医薬品としては適していないことから、本研究では以下の条件のもと、ミニマクロファージ活性化因子の設計と合成に挑みました。
1:ペプチド固相合成法で容易に合成できること
2:ペプチドは元々の配列に近いこと
3:糖加水分解酵素に耐性であること
4:MAFの部分構造を反映していること
バイオ医薬品*6において、糖鎖が生物活性に重要な機能を有する場合はあるものの、細胞などを用いた合成では糖鎖の制御は困難です。したがって、人工的に合成した糖鎖をタンパク質に導入する必要があり、その場合、糖鎖が分解されないように工夫することが重要となります。本研究では、αGalNAcのグリコシド結合*7が酸素の同族体である硫黄に置き換えた分子を化学合成して用いました(実際はαGalNAcThr/Ser*8の代わりにαGalNAcCys*9を導入)。また、分子のコンフォメーション*10を正しく導くため、C-未満およびN-末端のアミノ酸をCys(システイン)*11に置き換え、ジスルフィド結合*12により環化させました。このような中程度の分子サイズの医薬品は、今後重要になると考えられ、次世代のバイオ医薬品開発に大きく貢献することが期待されます。
■研究背景と経緯
バイオ医薬品の利用が開始されてから40年以上が経過しました。しかし、その多くは培養細胞を用いて生産されるため糖鎖構造の制御は困難であり、バイオ医薬品の限界の一つとなっています。さらに、仮に化学的、酵素化学的手法で糖鎖の構造を制御したとしても、医薬品として用いたとき、体内で一定の分解反応に晒されるため、薬効が続かないという問題があります。本研究では、こうした本質的な問題を解決するため、バイオ医薬品と同等の効果がある中程度の分子を用いれば化学合成が可能であると考え、この課題解決を検討しました。
■研究内容
上記の目的に従い、すでにマクロファージの活性化にとって重要であることが判明しているMAFの部分構造に注目しました。タンパク質の結晶構造から、403番目と430番目のアミノ酸の側鎖が空間的に近い位置にあることがわかり、これらのアミノ酸をCysに置き換え、ジスルフィド結合とした28個のアミノ酸からなる環状ペプチドの合成を行いました。この時に、420番目に相当するThrにはαGalNAcを導入する必要がありましたが、糖加水分解酵素による破壊から守るため、αGalNAcCysとして酵素反応に対する耐性を付与しました。このようにして合成した環状糖ペプチドは、αGalNAc加水分解酵素に耐性を示すとともに、LPS(リポ多糖)*13で刺激したマクロファージモデル細胞において、インターロイキン12*14の産生を増強することが判明しました。
■今後の展開
本研究の成果は、バイオ医薬品の新たな開発の流れを示しています。今後は、MAFに限らず、鍵となる場所に酵素分解に耐性の結合を導入した糖タンパク質や糖ペプチドを提供することで、これまで以上にバイオ医薬品の開発を早く進めることが可能になると期待されます。
■掲載論文
| 論文タイトル | : | A concept of future glycoprotein drugs: Synthesis of a thioglycosidically linked a-N-acetylgalactosamine-carrying cyclic peptide as a model of miniature macrophage activating factor(日本語:未来の糖タンパク質医薬のコンセプト:チオグリコシドで結合したα-N-アセチルガラクトサミンを有する環状ペプチドをミニマウロファージ活性化因子モデルとして合成) |
| 著者名 | : | 蟹江治(bet36体育投注_bet36体育官网app-在线*开户工学部生物工学科教授)、片山秀和(帝京大学リベラルアーツセンター教授)、岩岡道夫(bet36体育投注_bet36体育官网app-在线*开户理学部化学科教授)、小島直也(bet36体育投注_bet36体育官网app-在线*开户工学部生命化学科元教授)、蟹江善美(bet36体育投注_bet36体育官网app-在线*开户工学部生物工学科研究員)神崎浩太朗(bet36体育投注_bet36体育官网app-在线*开户大学院工学研究科)、中込雄万(bet36体育投注_bet36体育官网app-在线*开户工学部生命化学科)、浅見悠里(bet36体育投注_bet36体育官网app-在线*开户大学院工学研究科)、本間春城、横山佳、関穂乃香、今峰朋香、七海美帆、伊澤俊樹(bet36体育投注_bet36体育官网app-在线*开户工学部生命化学科)、三澤颯子(bet36体育投注_bet36体育官网app-在线*开户理学部化学科) |
| 掲載誌 | : | Journal of the American Chemical Society |
| DOI | : | 10.1021/jacs.4c18712 |
■用語解説
*1 環状ペプチド:ペプチド鎖の一部が化学結合により環化した物質の総称で、本研究においてはN-末端とC-末端に配したシステインの側鎖である二つのチオールがジスルフィド結合を形成して環状構造となっている。
*2 マクロファージ:私たちの体を守る免疫機構の中で、体内を循環して異物を見つけると他の免疫細胞に情報を伝えたり、排除したりする重要な細胞である。
*3 マクロファージ活性化因子(MAF):マクロファージを刺激して細胞障害性の液性因子を放出させる物質である。
*4 α-N-アセチルガラクトサミン(αGalNAc):糖タンパク質や糖脂質を構成している単糖の内の一つで、粘膜に存在するムチンで重要である。
*5 αガラクトサミン加水分解酵素活性:糖タンパク質や糖脂質の糖鎖中に存在するαGalNA残基が露出したとき、これを加水分解する酵素。
*6 バイオ医薬品:遺伝子組み換え技術や細胞培養などにより製造した医薬品であり、主にタンパク質を主成分とする。
*7 グリコシド結合:タンパク質や低分子化合物が配糖体として糖が付与されている場合、糖をグリコンと言い、それ以外をアグリコンと言うが、この時、両者を連結している結合(通常はアセタール結合である)をグリコシド結合と呼ぶ。糖鎖を構成する単糖間の結合も同様である。
*8 αGalNAcThr/Ser:GalNAcがα配置でタンパク質を構成するトレオニン(Thr)やセリン(Ser)の水酸基に結合した物質。
*9 αGalNAcCys:GalNAcがα配置でシステイン (Cys)のチオール基に結合した物質。
*10 コンフォメーション:折りたたみとも呼ばれ、ポリペプチド鎖が折りたたまり生じた比較的安定な一定の三次元構造。
*11 Cys(システイン):20種のアミノ酸の一つで、タンパク質のコンフォメーションの維持などに重要な役目を果たす。
*12 ジスルフィド結合:タンパク質中に複数のCysが存在する場合のように、二つのチオール基が酸化されて生じる硫黄原子と硫黄原子が形成する共有結合。
*13 LPS(リポ多糖):土壌菌などの細胞壁成分として広く知られ、脂質部分と多糖部分からなっています。マクロファージを活性化することでも知られている。
*14 インターロイキン12:他の免疫細胞に対して作用して細胞障害性免疫を活性化するサイトカインの一つである。
| <研究に関するお問い合わせ>bet36体育投注_bet36体育官网app-在线*开户工学部生物工学科 蟹江治TEL. 0463-63-4613 帝京大学リベラルアーツセンター 片山秀和TEL. 028-627-7190(直通) <広報に関するお問い合わせ>bet36体育投注_bet36体育官网app-在线*开户学長室(広報)担当:喜友名(きゆな)、林 TEL.0463-63-4670(直通) E-mail:upr@tokai.ac.jp帝京大学本部広報課 守川TEL. 03-3964-4162(直通) E-mail:kouhou@teikyo-u.ac.jp |




